Il PET (polietilene tereftalato) è una resina polimerica termoplastica, utilizzata come contenitore per bevande e alimenti, come fibre per abiti ma è anche utilizzata in celle fotovoltaiche a strato sottile. Nella sua forma amorfa, che si ha quando le molecole vengono fatte raffreddare velocemente e non hanno il tempo di riordinarsi, il PET è trasparente, mentre in quella semi-cristallina è opaca e bianca.
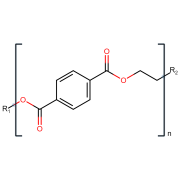
L’unità base di questo polimero è costituita da acido tereftalico condensato con etilene.
Questo poliestere viene utilizzato come contenitore di bevande per le sue proprietà fisiche di barriera per i gas e l’umidità, per la sua resistenza agli urti, per la sua resistenza a temperature elevate (il polimero può raggiungere i 72°C sopra i quali diventa gommoso) e per il suo basso costo di produzione.

Nel 2015 sono state prodotte 20 milioni di tonnellate di PET per diversi utilizzi, se per semplificare ipotizzassimo che tutto questo PET sia stato utilizzato per produrre le classiche bottigliette d’acqua da 0,5L dal peso di circa 9,89 grammi e dal diametro di 5,8 cm, saremmo in grado, con queste bottigliette, di ricoprire per ben due volte la superficie dell’Italia!
Produzione
La produzione industriale del PET può avvenire mediante reazioni di transesterificazione o esterificazione:
-
- DMT process: il dimetil-tereftalato è fatto reagire con un eccesso di glicole etilenico a temperature di 150-200°C in catalisi basica. Il metanolo che si produce è rimosso mediante distillazione. Il secondo step è condotto a temperature più elevate di circa 270-280°C e porta alla formazione del polimero e all’evaporazione del glicole in eccesso.
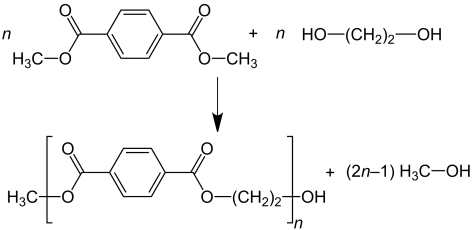
Transesterificazione By Jü – Own work, CC BY-SA 4.0 - Esterificazione del tereftalato: glicole etilenico è fatto reagire con tereftalato acido con temperature di 220-260°C e pressioni di 2,7-5,5 bar. L’acqua che è formata è eliminata per distillazione direttamente durante la reazione.

Esterificazione By Jü – Own work, CC BY-SA 4.0
- DMT process: il dimetil-tereftalato è fatto reagire con un eccesso di glicole etilenico a temperature di 150-200°C in catalisi basica. Il metanolo che si produce è rimosso mediante distillazione. Il secondo step è condotto a temperature più elevate di circa 270-280°C e porta alla formazione del polimero e all’evaporazione del glicole in eccesso.
Riciclaggio
 Il PET è un materiale riciclabile, può seguire due principali processi di riciclaggio: uno meccanico e uno chimico. Il riciclaggio meccanico consiste nel ridurre in polvere il PET e rifonderlo in nuovi oggetti non più ad uso alimentare. Il riciclaggio chimico permette invece di riottenere i monomeri di partenza e quindi creare nuovamente PET anche per uso alimentare, quest’ultimo metodo è vantaggioso perché non produce prodotti deprezzati di qualità inferiore.
Il PET è un materiale riciclabile, può seguire due principali processi di riciclaggio: uno meccanico e uno chimico. Il riciclaggio meccanico consiste nel ridurre in polvere il PET e rifonderlo in nuovi oggetti non più ad uso alimentare. Il riciclaggio chimico permette invece di riottenere i monomeri di partenza e quindi creare nuovamente PET anche per uso alimentare, quest’ultimo metodo è vantaggioso perché non produce prodotti deprezzati di qualità inferiore.
Processi biotecnologici
Nel 2016 è stato scoperto un batterio (Ideonella sakaiensis) che si nutre del PET che viene digerito da due enzimi Mhetase e Petase, nel 2018 è state sequenziata la struttura proteica della Petase ed ora anche quella della Mhetase. L’enzima Petase è una forbice molecolare che scompone il materiale plastico in monomeri mentre la Mhetase scompone in glicole etilenico e acido tereftalico il PET.

Emergenza plastica
Uno studio pubblicato sulla rivista Nature del 2016 ha analizzato l’inquinamento nel mediterraneo da materiale plastico e micro-plastico, il più abbondante tipo di plastica analizzata è il polietilene con un’abbondanza del 52%, seguito poi dal polipropilene 16%. Anche il PET, nonostante sia un materiale completamente riciclabile è stato ritrovato anche se in basse percentuali (<1%).
MACPLAS ONLINE – www. macplas.it
SCIENTIFIC REPORT n.1717 (2019) – Nature.com – Scructure of the plastic – degrading Ideonella sakaiensis Mhetase bound to a substrate
SCIENTIFIC REPORT n.37551 (2016) – Nature.com – The Mediterranean Plastic Soup

Quest’opera è distribuita con Licenza Creative Commons Attribuzione – Non commerciale 4.0 Internazionale