Introduzione
L’emoglobina (abbreviata Hb) è una proteina appartenente alla classe delle globine e come la maggior parte delle proteine di questa classe, svolge funzione di immagazzinatore di ossigeno. La struttura quaternaria è un tetramero costituito da due catene α di 141 residui ciascuna e di due catene β di 146 residui ciascuna. Sono presenti sia interazioni di tipo idrofobico che ponti idrogeno e coppie ioniche che stabilizzano la struttura quaternaria.
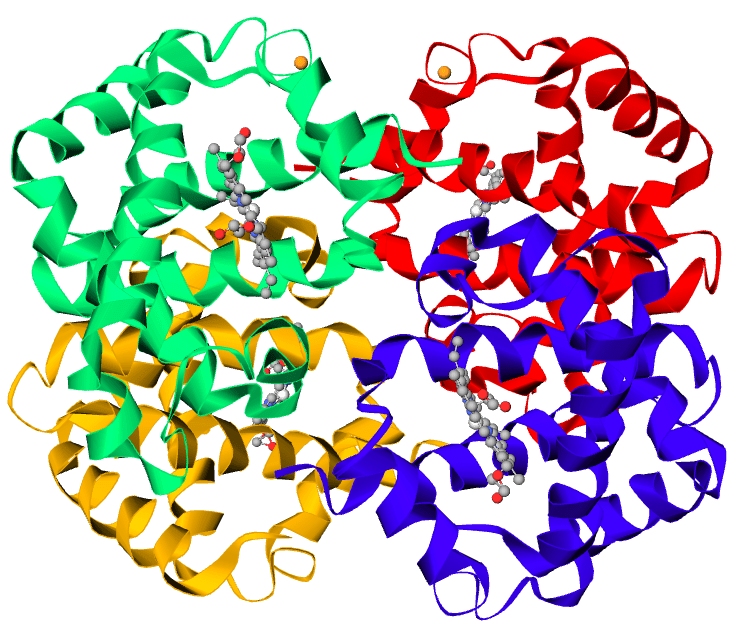
Ognuna delle quattro catene trasporta un gruppo eme, costituito da una molecola organica complessa (la protoporfirina) che coordina uno ione ferroso (Fe2+). Questo metallo è in grado di formare sei legami di coordinazione: quattro sono utilizzati per legare l’azoto degli anelli pirrolici e altri due perpendicolari alla protoporfirina che legano da un lato un residuo di istidina della proteina e dall’altro lega in modo reversibile una molecola di ossigeno.
Il ferro è anche il responsabile della colorazione rossa del nostro sangue!
Stati conformazionali
L’emoglobina può esistere in due stati conformazionali differenti: T (tesa) e R (rilassata). Lo stato R ha una maggior affinità per l’ossigeno e quindi sarà la forma prevalente dell’ossiemoglobina. Lo stato T è la conformazione della deossiemoglobina. La transizione tra questi due stati determina una rottura e formazione di nuovi legami ionici.
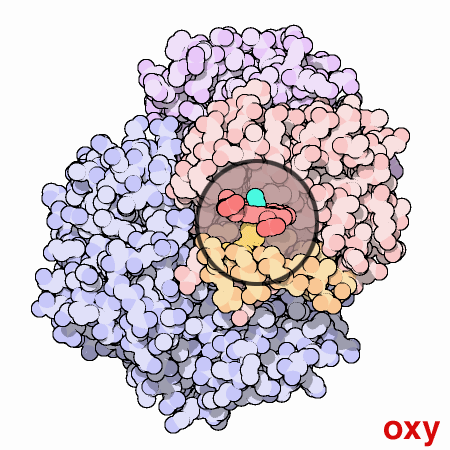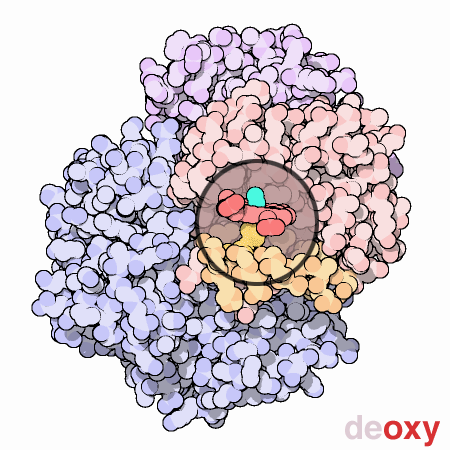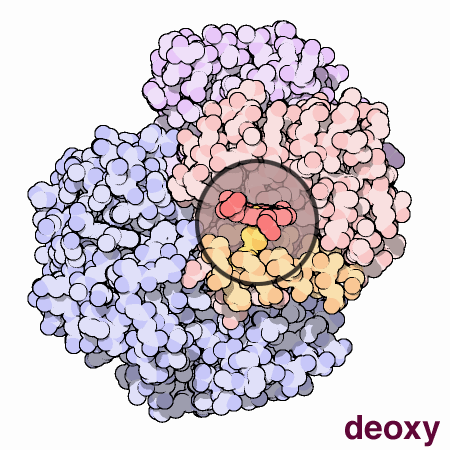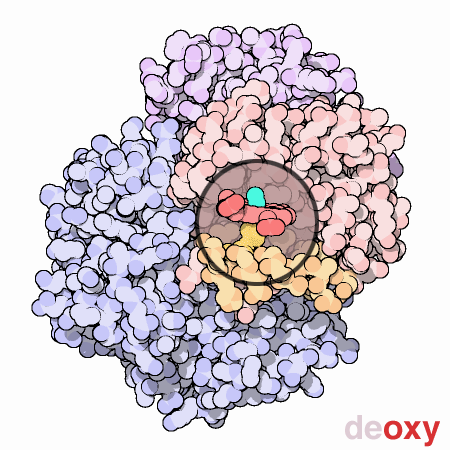
doi:10.2210/rcsb_pdb/mom_2003_5
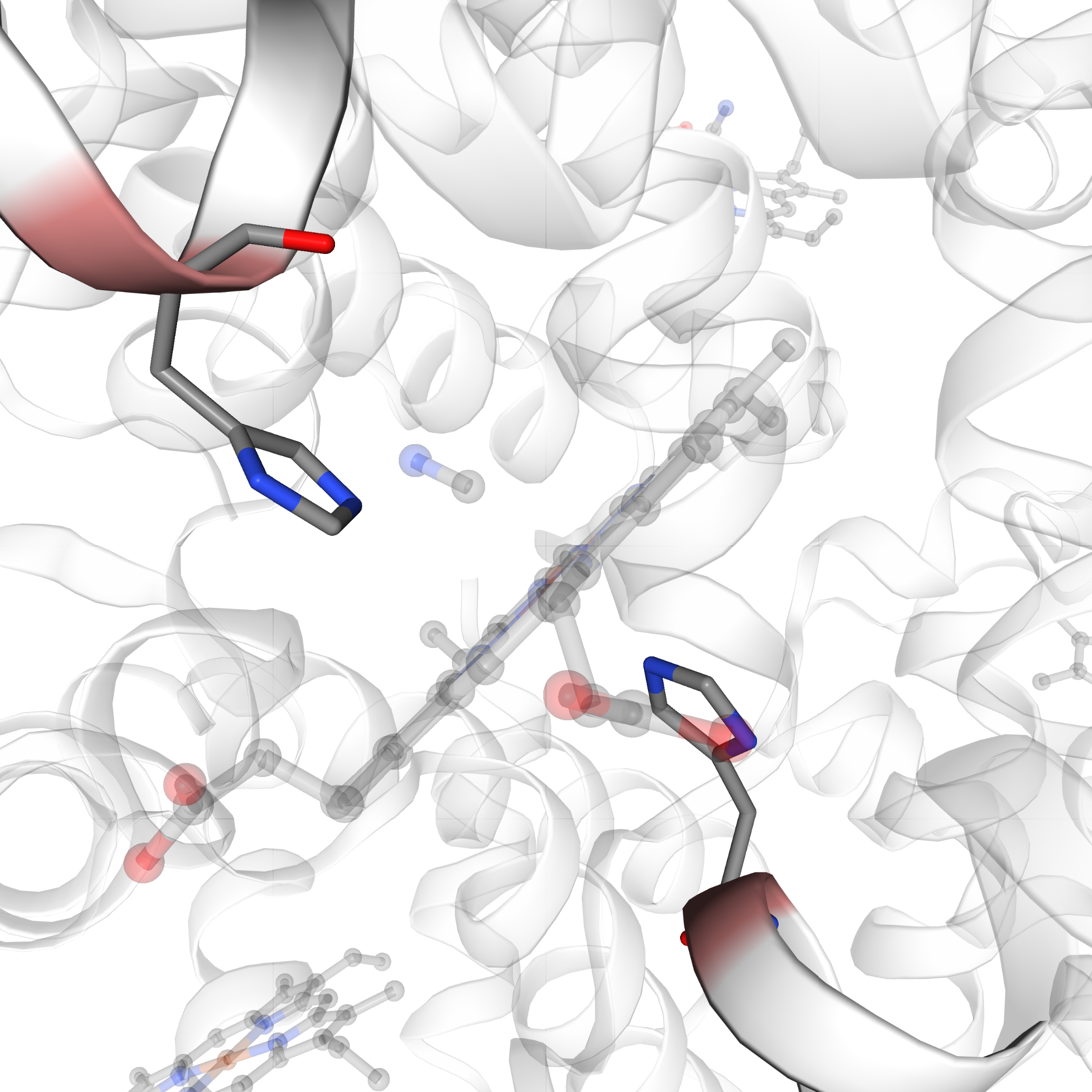
Nella forma T il gruppo eme tende ad assumere una forma a cupola dove l’atomo di Fe viene ad essere attratto dall’istidina prossimale, nella forma R il gruppo eme e l’atomo di Fe sono sullo stesso piano. Le due immagini rappresentano uno zoom del gruppo eme rispettivamente nella forma T e R.
La possibilità di modificare il proprio stato di transizione determina una curva di legame all’ossigeno sigmoide. Questo determina una bassa affinità all’ossigeno a basse pressioni parziali e un’alta affinità ad alte pressioni parziali di ossigeno (curva verde).
Funzione metaboliche
L’emoglobina ha un ruolo fondamentale nel trasporto dell’ossigeno dai polmoni ai tessuti periferici. L’affinità all’ossigeno può spiegare l’azione svolta da questa proteina: la pressione parziale di ossigeno nei polmoni è di circa 13,3 kPa (99,7 mmHg) e l’emoglobina è quasi completamente saturata (lega il massimo numero di molecole di ossigeno) mentre nei tessuti periferici la pressione parziale di ossigeno è 4 kPa (30 mmHg) e qui l’emoglobina cede ossigeno perché la sua affinità è ridotta.

Il legame cooperativo con l’ossigeno fa aumentare l’affinità della proteina stabilizzandola nella forma R.
Emoglobina fetale
Nello sviluppo fetale l’emoglobina del feto (HbF) svolge un ruolo chiave in quanto è richiesto un elevato numero di molecole di ossigeno per la crescita del feto. Questa emoglobina si differenzia da quella di un adulto (HbA) per le catene β che sono sostituite da due catene γ formando il tetramero α2γ2 più affine all’ossigeno (vedi grafico curva blu).
Effetto Bohr
L’emoglobina è in grado di legare e trasportare anche protoni (H+) o molecole di CO2. Nei tessuti periferici le concentrazioni di anidride carbonica e protoni sono elevate in quanto sono scarti derivanti dal metabolismo cellulare ciò rende la proteina meno affine all’ossigeno che viene ceduto alle cellule bersaglio.
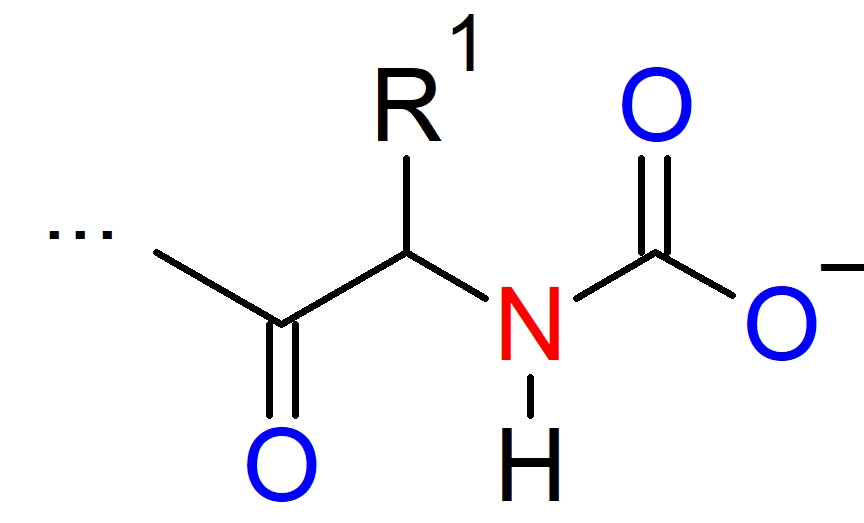
Il protone si lega sulle catene laterali dei diversi residui amminoacidici della proteina mentre l’anidride carbonica si lega all’estremità amminoterminale di ciascuna subunità sotto forma di carbammato.
Regolazione da 2,3-bisfosfoglicerato
Il 2,3-bisfosfoglicerato è un modulatore allosterico eterotropico, si lega quindi in un punto diverso dal sito attivo ed è una molecola diversa dal comune substrato della proteina. Questa molecola, legandosi tra le due subunità β, favorisce la conformazione T riducendo l’affinità della proteina all’ossigeno.
Nell’emoglobina fetale, dove le catene β sono sostituite da catene γ, il 2,3-bisfosfoglicerato ha un’affinità minore e questo permette all’HbF di essere più affine all’ossigeno.
Il 2,3-bisfosfoglicerato è utile anche in condizioni di ipossia o di basse pressioni parziali di ossigeno nei polmoni (come ad esempio in alta quota). In questi casi vengono prodotte maggiori quantità di 2,3-BPG che determinano una minima variazione in negativo dell’ossigeno che l’emoglobina riesce a legare nei polmoni ma soprattutto una più marcata diminuzione dell’affinità all’ossigeno a basse pressioni parziali, permettendo all’Hb di cedere più alte quantità di ossigeno nei tessuti periferici.
- A livello del mare l’emoglobina è saturata a quasi il 100% nei polmoni, mentre nei tessuti periferici circa il 60% quindi è in grado di cedere il 40% di ossigeno.
- Ad altitudini elevate (circa 4500m) se non ci fosse una variazione di 2,3-BPG l’emoglobina rilascerebbe solo il 30% in quanto a quella quota nei polmoni la pressione parziale di ossigeno è inferiore (circa 7,5 kPa) e quindi l’Hb si satura solo per il 90 % circa
- Ad altitudini elevate (circa 4500m) con una maggior produzione di 2,3-BPG l’emoglobina riesce a cedere circa il 37% dell’ossigeno perché l’effetto di riduzione dell’affinità è maggiore nei tessuti consentendo il rilascio di quantità maggiori di ossigeno
Regolazione in breve
| Cambiamento | Fattore | Effetto |
|---|---|---|
| Aumento di | CO2 | Diminuzione affinità |
| Diminuzione di | CO2 | Aumento affinità |
| Aumento di | H+ | Diminuzione affinità |
| Diminuzione di | H+ | Aumento affinità |
| Aumento di | 2,3-BPG | Diminuzione affinità |
| Diminuzione di | 2,3-BPG | Aumento affinità |
| Aumento di | Temperatura | Diminuzione affinità |
| Diminuzione di | Temperatura | Aumento affinità |
L’aumento dell’affinità porta ad uno shift della curva sigmoidea verso sinistra, viceversa una diminuzione porta ad uno shift verso sinistra.
Ti suggeriamo anche: mioglobina
Fonti
Marengo-Rowe A. J. (2006). Structure-function relations of human hemoglobins. Proceedings (Baylor University. Medical Center), 19(3), 239–245. https://doi.org/10.1080/08998280.2006.11928171
May 2003, Shuchismita Dutta, David Goodselldoi:10.2210/rcsb_pdb/mom_2003_5