L’istamina (C5H9N3) è un’ammina composta da un anello imidazolico e un gruppo amminico.
Fa parte della classe delle ammine biogene, ovvero ammine biologicamente attive ed ottenuta mediante decarbossilazione di amminoacidi. L’amminoacido dal quale deriva l’istamina è l’istidina.

Questa molecola si trova nelle piante, nei batteri, nei veleni di insetti e negli umani. In questi ultimi, l’istamina è immagazzinata all’interno dei granuli di cellule del sistema immunitario, i mastociti e i basofili. I mastociti sono localizzati nei tessuti, vicino ai piccoli vasi e alle terminazioni nervose, mentre i basofili viaggiano per il circolo sanguigno.
L’istamina è un importante mediatore delle reazioni allergiche in quanto aumenta la secrezione di citochine e chemochine da parte dei linfociti Th2 e ne diminuisce la secrezione da parte dei linfociti Th1.
Recettori istaminergici
I recettori dell’istamina sono quattro e sono proteine transmembrana accoppiate a proteine G.
H1
Coinvolto nelle reazioni allergiche, il recettore H1 è espresso in diversi tessuti e cellule tra cui nervi, epitelio respiratorio, cellule endoteliali di piccoli vasi e muscolatura liscia.
Questo recettore è accoppiato alle proteine Gq che, attivando la fosfolipasi C, aumenta la concentrazione intracellulare di calcio. Questo comporta la contrazione della muscolatura liscia dei bronchi e aumenta la permeabilità vascolare. A livello del cervello permette il mantenimento dello stato di veglia.
La sua attivazione aumenta la produzione di chemochine, le quali servono per guidare le cellule del sistema immunitario verso il sito di infiammazione. L’attivazione del recettore H1 è coinvolta nell’insorgenza di asma, dermatite atopica e prurito (per l’istamina che induce la produzione di IL-31).
H2
Espresso nei linfociti B e T, cellule dendritiche, nelle cellule parietali gastriche, nel cervello e cuore.
Questo recettore è accoppiato alle proteine Gs e una volta attivato, aumenta la produzione di AMP ciclico.
Nello stomaco, induce la secrezione gastrica. Esistono infatti farmaci antistaminici che, bloccando questo recettore, agiscono come antiacidi.
Questo recettore è importante anche per la secrezione mucosa nelle vie aeree e aumenta la permeabilità vascolare. Inoltre, è coinvolto nell’attivazione della risposta immunitaria.
H3
E’ espresso soprattutto a livello dell’SNC ed è accoppiato alle proteine Gi. La loro attivazione comporta una riduzione della produzione di AMP ciclico.
Un ruolo importante di questo recettore è quello di regolare la biosintesi dell’istamina, bloccandone la produzione quando l’istamina stessa lega al recettore. Inoltre, regola il ciclo di dormi-veglia e l’infiammazione.
E’ associato alla rinite perché è espresso nei nervi presinaptici a livello delle ghiandole nasali sub-mucosali e quando viene attivato, stimola la secrezione da parte di queste ghiandole.
H4
Accoppiato alle proteine Gi, è espresso su varie cellule del sistema immunitario, milza, intestino, polmoni, SNC e nelle cellule tumorali.
L’attivazione delle proteine Gi comporta una diminuzione della produzione di AMP ciclico, con conseguente aumento della MAPK e calcio intracellulare.
Nelle reazioni allergiche, H4 media l’attivazione dei mastociti e questo comporta la produzione di diverse chemochine e citochine infiammatorie.
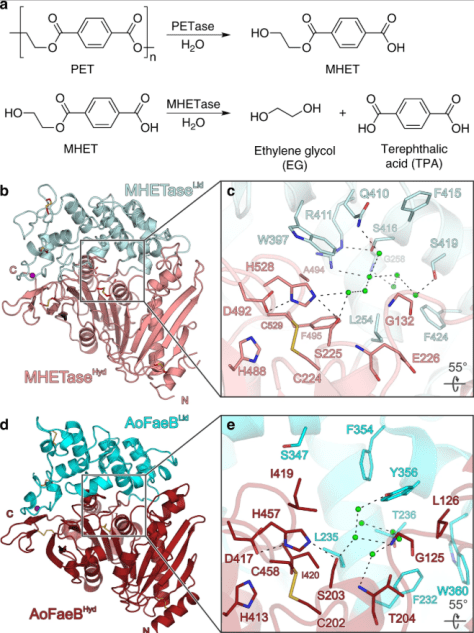
A seguito dell’incontro con l’allergene, i mastociti vengono guidati verso il sito dove si manifesta la reazione allergica (fenomeno di chemiotassi) e successivamente viene indotta la degranulazione, ovvero il processo nel quale i mastociti rilasciano all’esterno l’istamina contenuta nei loro granuli. Lo stesso processo avviene con i basofili, a seguito dell’incontro con l’allergene.
Inoltre, l’attivazione di H4 comporta l’induzione della migrazione degli eosinofili, aumentando la risposta immunitaria.

Intolleranza all’istamina
Questa condizione è dovuta principalmente alla mancata degradazione dell’istamina, nel quale l’enzima DAO (diammino ossidasi) non funziona. C’è quindi un aumento della concentrazione di istamina nel plasma.
Per questo motivo è importante ridurre il consumo di alimenti ricchi di istamina, quali:
- Prodotti pronti o in scatola
- Alcol, aceto, lievito
- Insaccati
- Pesce in scatola e frutti di mare
- Formaggi
- Spinaci, pomodori, melanzane, avocado
I sintomi si manifestano durante e dopo il pasto e sono quelli di una classica intolleranza: prurito ed arrossamenti sul corpo, disturbi gastrointestinali, mal di testa, raffreddore cronico, labbra gonfie.
Farmaci antistaminici
Gli antistaminici sono usati per trattare le reazioni allergiche e sono disponibili in vari formati: compresse, crema o spray.
Questi farmaci agiscono come antagonisti, legando il recettore istaminergico e bloccando il rilascio di istamina quando l’organismo entra in contatto con l’allergene.
Antagonisti del recettore H1
1° generazione:

Hanno una struttura tanto lipofilica da poter passare la barriera ematoencefalica, causando stanchezza.
A causa della bassa selettività per il recettore H1, possono legare anche altri recettori (della serotonina, colinergico e alfa-adrenergico). Questo comporta lo sviluppo di una serie di effetti collaterali: secchezza delle fauci, tachicardia, tremolii e aumento dell’appetito.
Oltre all’effetto principale, ovvero quello di bloccare l’azione dell’istamina e quindi fermare la reazione allergica, c’è anche l’effetto antiemetico.
2° generazione:

Sonoi ormai i più usati, in quanto strutturalmente meno lipofilici e quindi non sono in grado di passare la barriera ematoencefalica. Sono più selettivi nei confronti dei recettori H1 periferici, coinvolti nelle reazioni allergiche, e per questo motivo danno meno effetti collaterali.
3° generazione:
Sono i più recenti principi attivi scoperti, sono molto selettivi e per questo presentano ridotti effetti collaterali.
Antagonisti del recettore H4
Recentemente, è stato visto che anche gli antagonisti del recettore H4 potrebbero essere impiegati come antistaminici per il trattamento di allergie, ma al momento è ancora oggetto di studi.
Antagonisti del recettore H2
Questo tipo di antagonisti agiscono come gastroprotettori, per bloccare la secrezione di succhi gastrici indotta dall’istamina.
Sono usati per il trattamento del reflusso gastro-esofageo ed ulcere.

Fonti:
The Role of Histamine and Histamine Receptors in Mast Cell-Mediated Allergy and Inflammation: The Hunt for New Therapeutic Targets – link
Intolleranza all’istamina – link
Branco, Anna Cláudia Calvielli Castelo et al. “Role of Histamine in Modulating the Immune Response and Inflammation.” Mediators of inflammation vol. 2018 9524075. 27 Aug. 2018, doi:10.1155/2018/9524075 Tatarkiewicz, Jan et al. “New antihistamines - perspectives in the treatment of some allergic and inflammatory disorders.” Archives of medical science : AMS vol. 15,2 (2019): 537-553. doi:10.5114/aoms.2017.68534





















 L’esatto meccanismo d’azione non è stato tuttora completamente definito, secondo una prima teoria il paracetamolo sarebbe un debole inibitore delle cicloossigenasi 1 e 2 (COX1 e COX2) che sono coinvolte nella sintesi delle prostaglandine (molecole che inducono le sensazioni di dolore) a partire dall’acido arachidonico. Il paracetamolo non agisce sulle cicloossigenasi dei tessuti periferici per questo non ha nessun effetto anti-infiammatorio a livello periferico.
L’esatto meccanismo d’azione non è stato tuttora completamente definito, secondo una prima teoria il paracetamolo sarebbe un debole inibitore delle cicloossigenasi 1 e 2 (COX1 e COX2) che sono coinvolte nella sintesi delle prostaglandine (molecole che inducono le sensazioni di dolore) a partire dall’acido arachidonico. Il paracetamolo non agisce sulle cicloossigenasi dei tessuti periferici per questo non ha nessun effetto anti-infiammatorio a livello periferico.

 ed è l’aldeide che conferisce il caratteristico sapore e odore dolciastro e pungente. La sua biodisponibilità (quantità, dopo l’introduzione nell’organismo, effettivamente utilizzata) è piuttosto bassa, <20%, e la maggior parte è escreta dalle urine come acido cinnamico.
ed è l’aldeide che conferisce il caratteristico sapore e odore dolciastro e pungente. La sua biodisponibilità (quantità, dopo l’introduzione nell’organismo, effettivamente utilizzata) è piuttosto bassa, <20%, e la maggior parte è escreta dalle urine come acido cinnamico.
 L’acesulfme di potassio è un dolcificante intensivo artificiale non calorico in quanto il nostro corpo non è in grado di metabolizzarlo, viene assorbito a livello intestinale e secreto attraverso le urine e ha un potere dolcificante di circa 200 volte superiore del comune saccarosio.
L’acesulfme di potassio è un dolcificante intensivo artificiale non calorico in quanto il nostro corpo non è in grado di metabolizzarlo, viene assorbito a livello intestinale e secreto attraverso le urine e ha un potere dolcificante di circa 200 volte superiore del comune saccarosio.




 Il PET è un materiale riciclabile, può seguire due principali processi di riciclaggio: uno meccanico e uno chimico. Il riciclaggio meccanico consiste nel ridurre in polvere il PET e rifonderlo in nuovi oggetti non più ad uso alimentare. Il riciclaggio chimico permette invece di riottenere i monomeri di partenza e quindi creare nuovamente PET anche per uso alimentare, quest’ultimo metodo è vantaggioso perché non produce prodotti deprezzati di qualità inferiore.
Il PET è un materiale riciclabile, può seguire due principali processi di riciclaggio: uno meccanico e uno chimico. Il riciclaggio meccanico consiste nel ridurre in polvere il PET e rifonderlo in nuovi oggetti non più ad uso alimentare. Il riciclaggio chimico permette invece di riottenere i monomeri di partenza e quindi creare nuovamente PET anche per uso alimentare, quest’ultimo metodo è vantaggioso perché non produce prodotti deprezzati di qualità inferiore.