La mioglobina (Mb) è una proteina globulare citoplasmatica che si differenzia dall’emoglobina perché presenta una sola catena polipeptidica di 153 residui amminoacidici che lega un solo gruppo prostetico (eme).
Leggi l’articolo dell’emoglobina dove trattiamo le funzionalità del gruppo eme (link)
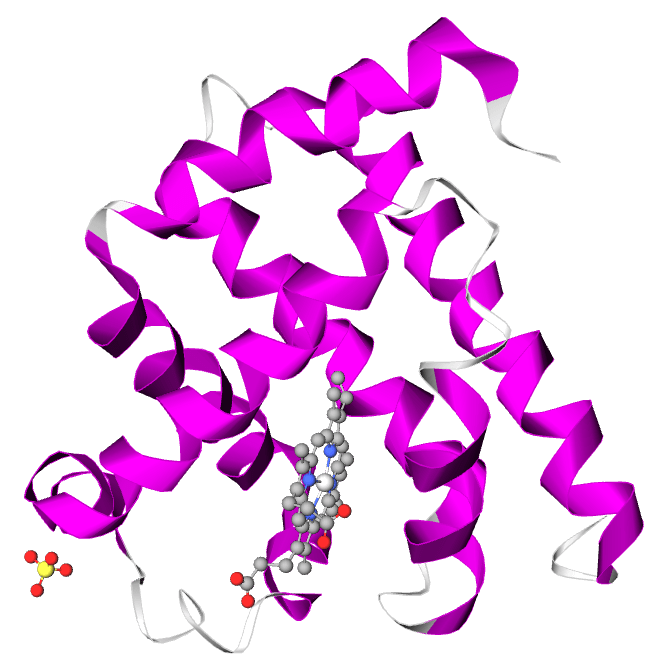
La mioglobina è in grado di legare reversibilmente una molecola di ossigeno alla volta con un’affinità superiore rispetto all’emoglobina, ha infatti la funzione di conservare l’ossigeno nei tessuti periferici (in particolare nei muscoli scheletrici e cardiaci) e di rilascialo in caso di ipossia o anossia.
Diversamente dall’emoglobina, la mioglobina, ha un’affinità all’ossigeno superiore e descritta da una curva iperbolica e non sigmoidale.

Il legame con l’ossigeno dipende esclusivamente dai movimenti molecolari (respirazione) della proteina e non dal legame cooperativo con l’ossigeno. La saturazione della proteina si ha già a basse pressioni parziali di ossigeno.
In questo modo l’emoglobina, una volta raggiunti i tessuti periferici, può trasferire le molecole di ossigeno alla mioglobina che le tratterrà e rilascerà al bisogno.
L’espressione della mioglobina è aumentata nei muscoli sottoposti a contrazioni croniche e nelle persone che vivono in alta quota.
L’emoglobina e l’imbrunimento della carne
Al supermercato chi non ha mai scelto la carne per il suo colore? Una carne dal colore rosso brillante avrà statisticamente più possibilità di essere venduta rispetto ad una carne dal colore meno roseo.
La mioglobina è il principale responsabile della colorazione della carne fresca mentre l’emoglobina contenuta nel sangue viene persa durante il taglio e quindi influisce in minima parte.
Nelle carni fresche la mioglobina può esistere in quattro diverse forme: la ossimioglobina (OxyMb), carbossimioglobina (COMb), deossiemoglobina (DeoxyMb) e metamioglobina (MetMb). Le prime tre presentano uno ione ferroso (Fe2+) mentre la MetMb lo ione ferrico (Fe3+). Le forme OxyMb e COMb sono di colore rosso ciliegia mentre la forma DeoxyMb è violacea e la forma ossidata MetMb, dove l’ossigeno è sostituito da una molecola di acqua, è marroncina. La causa della colorazione brunastra è data quindi dall’ossidazione dell’atomo di ferro che passa da 2+ a 3+.

L’imballaggio e l’addizione di antiossidanti sono le due tecniche principali per prevenire l’imbrunimento delle carni fresche.
MAP
Per la conservazione delle carni si usano imballaggi ad atmosfera modificata MAP (Modified Atmosphere Packaging). Vengono utilizzate atmosfere protettive ad alto contenuto in ossigeno e anidride carbonica e a basso contenuto di monossido di carbonio (inferiore allo 0.4%) e azoto.
Una nuova frontiera delle MAP è l’utilizzo di atmosfere “ricche” in CO (fino all’1%) che prolungano la shelf life (durabilità) fino a 21 giorni rispetto ai 14 giorni dell’atmosfera ricca in ossigeno.
Antiossidanti
Gli antiossidanti possono essere somministrati prima della macellazione o dopo per ridurre al minimo il deterioramento. Sono utilizzati sia antiossidanti naturali tra cui il rosmarino, estratti di semi d’uva o estratti di foglie d’olivo ma sono spesso utilizzati anche antiossidanti sintetici come i lattati, succinati, il piruvato. L’azione di questi antiossidanti varia anche a seconda dell’atmosfera che viene utilizzata nel packaging.
Myoglobin: an essential hemoprotein in striated muscle George A. Ordway, Daniel J. Garry Journal of Experimental Biology 2004 207: 3441-3446; doi: 10.1242/jeb.01172 Myoglobin Chemistry and Meat Color - Surendranath P. Suman and Poulson Joseph - Annual Review of Food Science and Technology 2013 4:1, 79-99